5 Transkriptom RNA Seq 2: Difference between revisions
No edit summary |
No edit summary |
||
| Line 6: | Line 6: | ||
* nur 1-2% der totalen RNA ist mRNA | * nur 1-2% der totalen RNA ist mRNA | ||
* 90% rRNA | * 90% rRNA | ||
** poly(A) Anreicherung | * weil wir nur die mRNA isolieren wollen, müssen wir diese von der restlichen RNA trennen | ||
** Abbau von rRNA | * das ist entweder durch die sogennante poly(A) Anreicherung möglich, dabeimacht man sich die besondere Eigenschaft der mRNA zu nutze | ||
* diese besitzt im Gegensatz zu anderen RNA Spezies einen polyA-Schwanz, immobilisiert man auf der Matrix einer Chromatofraphiesäule polyT-Seqeunezen, kann die mRNA komplementär an diese binden und kann so hufgereinigt werden | |||
* die zweite Möglichkeit ist der spezifische Abbau von rRNA | |||
* diese Vorgehensweise gewinnt vor allem bei Prokaryotischer mRNA an Bedeutung, bei der es keinen polyA-Schwanz gibt | |||
<br> | <br> | ||
<br> | <br> | ||
| Line 13: | Line 16: | ||
*Information über kodierenden Strang kann durch 2-stufige cDNA Synthese und dUTP Nukleotiden konserviert werden. | *Information über kodierenden Strang kann durch 2-stufige cDNA Synthese und dUTP Nukleotiden konserviert werden. | ||
<br> | <br> | ||
3' UUUUU-AAAA 5' mRNA mit polyA tail <br> | |||
↓Reverse Transcriptase <br> | |||
3' AAAAA-TTTT 5' cDNA Strang wird mit Reverse Transkriptase synthetisiert <br> | |||
↓Synthese des komplementären cDNA Strangs durch Polymerase <br> | |||
3' AAAAA-TTTT 5' <br> | |||
5' UUUUU-AAAA 3' cDNA Doppelstrang, dUTPs werden hinzugegeben keine dTTPs, dadurch Markierung des non-coding Strangs <br> | |||
A-A A-A A-TTT <br> | |||
U-U U-U U-AAA library preparation und Adapter Ligierung <br> | |||
* Abbau des non Coding Stranges durch durch URacil-DNA-Glykosylase | |||
< | * baut spezifisch den non coding Strang ab, weil dieser als einziger Uracil besitzt | ||
<br> | * d.h. alle zum cDNA-Originalstrang komplementären Stränge werden abgebaut | ||
* durch die Adapter bleibt die Topologie erhalten | |||
<br> | * es folgt die Amplifikation mittels PCR | ||
== 3. Sequenzierung/ Next generation Sequencing == | == 3. Sequenzierung/ Next generation Sequencing == | ||
* Sequenziertiefe bestimmt die Empfindlichkeit und die Genauigkeit | |||
* 5 Millionen reads ausreichend für mittel-hoch exprimierte Gene | |||
* 100 Millionen reads für schwach exprimierte Gene | |||
* wichtig: Anzahl an Replikaten bestimmt statistische Sensitivität für Unterschiede | |||
<big> | <big> | ||
| Line 60: | Line 54: | ||
|} | |} | ||
</big> | </big> | ||
== 4. | == 4. Datenanalyse == | ||
Präsprozessierung der Rohdaten: | |||
<br> | <br> | ||
⇒ Filtern von Basen mit geringer Qualität | ⇒Filtern von Basen mit geringer Qualität | ||
<br> | <br> | ||
⇒ Trimmen von Adaptersequenzen und PCR-Primersequenzen | ⇒ Trimmen von Adaptersequenzen und PCR-Primersequenzen | ||
| Line 69: | Line 64: | ||
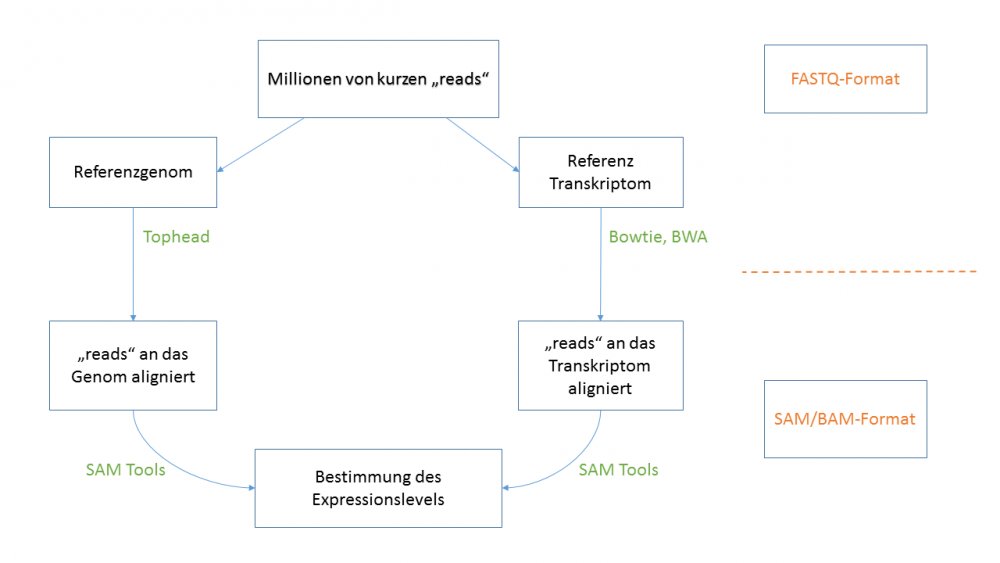
== 5. Read Alignment == | == 5. Read Alignment == | ||
[[File:Read-alignment.png| | [[File:Read-alignment.png|center|1000px]] | ||
Revision as of 12:29, 23 September 2021
RNAseq
RNA sequencing ist eine Methode zur Analyse von Transkriptomen. Hierbei wird die Sequenz aller in der Probe vorhandenen mRNA Moleküle durch Next-Generation Sequencing (NGS) ermittelt.
1. Isolierung von mRNA
- nur 1-2% der totalen RNA ist mRNA
- 90% rRNA
- weil wir nur die mRNA isolieren wollen, müssen wir diese von der restlichen RNA trennen
- das ist entweder durch die sogennante poly(A) Anreicherung möglich, dabeimacht man sich die besondere Eigenschaft der mRNA zu nutze
- diese besitzt im Gegensatz zu anderen RNA Spezies einen polyA-Schwanz, immobilisiert man auf der Matrix einer Chromatofraphiesäule polyT-Seqeunezen, kann die mRNA komplementär an diese binden und kann so hufgereinigt werden
- die zweite Möglichkeit ist der spezifische Abbau von rRNA
- diese Vorgehensweise gewinnt vor allem bei Prokaryotischer mRNA an Bedeutung, bei der es keinen polyA-Schwanz gibt
2. cDNA Synthese und Library Präparation
- Information über kodierenden Strang kann durch 2-stufige cDNA Synthese und dUTP Nukleotiden konserviert werden.
3' UUUUU-AAAA 5' mRNA mit polyA tail
↓Reverse Transcriptase
3' AAAAA-TTTT 5' cDNA Strang wird mit Reverse Transkriptase synthetisiert
↓Synthese des komplementären cDNA Strangs durch Polymerase
3' AAAAA-TTTT 5'
5' UUUUU-AAAA 3' cDNA Doppelstrang, dUTPs werden hinzugegeben keine dTTPs, dadurch Markierung des non-coding Strangs
A-A A-A A-TTT
U-U U-U U-AAA library preparation und Adapter Ligierung
- Abbau des non Coding Stranges durch durch URacil-DNA-Glykosylase
- baut spezifisch den non coding Strang ab, weil dieser als einziger Uracil besitzt
- d.h. alle zum cDNA-Originalstrang komplementären Stränge werden abgebaut
- durch die Adapter bleibt die Topologie erhalten
- es folgt die Amplifikation mittels PCR
3. Sequenzierung/ Next generation Sequencing
- Sequenziertiefe bestimmt die Empfindlichkeit und die Genauigkeit
- 5 Millionen reads ausreichend für mittel-hoch exprimierte Gene
- 100 Millionen reads für schwach exprimierte Gene
- wichtig: Anzahl an Replikaten bestimmt statistische Sensitivität für Unterschiede
| Replikate pro Gruppe | |||
| fold change | 3 | 5 | 10 |
| 1,25 | 17% | 25% | 44% |
| 1,5 | 43% | 64% | 91% |
| 2 | 87% | 98% | 100% |
4. Datenanalyse
Präsprozessierung der Rohdaten:
⇒Filtern von Basen mit geringer Qualität
⇒ Trimmen von Adaptersequenzen und PCR-Primersequenzen
⇒ Programme: FASTQC, NGSQC, Trimmomatic